Il faut respecter impérativement certaines règles.
Choix de la zone à biopsier :
Le problème ne se pose que si la totalité de la lésion n’est pas prélevée.
Cette zone doit être représentative de l’ensemble de la lésion.
Si la lésion est homogène : en général, un seul prélèvement suffit.
Si la lésion est inhomogène : ne pas hésiter à réaliser plusieurs prélèvements de manière à avoir les différents aspects de la lésion à analyser. Chaque prélèvement sera conditionné seul dans un flacon numéroté.
Cas particuliers :
- Ulcérations : ne pas biopsier dans la zone ulcérée et/ou nécrotique, elles sont le plus souvent non spécifiques et/ou ininterprétables. La biopsie doit comprendre 2/3 de tissu sain et 1/3 de tissu lésionnel (figure 1).
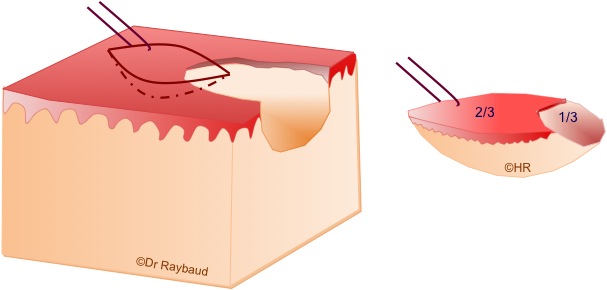
Figure 1. Prélèvement d’une zone ulcérée (2/3 en bordure de l’ulcération et 1/3 dans l’épithélium).
On réalise une première incision elliptique assez profonde du côté le plus difficile d’accès, de manière à libérer suffisamment le fragment, pour ensuite passer un fil de suture qui permet de tenir délicatement le prélèvement puis on réalise une deuxième incision qui rejoint la précédente en profondeur.
- Lésions bulleuses : prélever, si possible, une bulle intacte ; situation rarissime en bouche car la bulle perd rapidement son toit et on observe une ulcération (figure 2).
L’étude en congélation est indispensable pour le diagnostic des dermatologies bulleuses, celle-ci se fera sur une muqueuse dite “saine”, prélevée à distance des lésions.
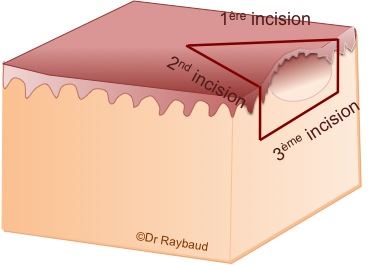
Figure 2. Prélèvement d’une bulle intacte, une troisième incision est nécessaire pour recueillir la lésion entièrement, elle doit passer sous la lésion.
- Lésions mélaniques : prélever la totalité de la lésion, en profondeur et en périphérie avec une marge de tissu sain (toute exérèse partielle ou superficielle d’un mélanome malin peut s’avérer dramatique).
Taille du prélèvement :
Il ne faut pas faire de petites biopsies : un fragment minuscule ne permettra pas une bonne orientation du prélèvement et l’interprétation sera rendue difficile, voire impossible.
Les dimensions idéales d’une biopsie (figures 3 et 4):
– elliptique : 1 cm de long sur 0,5 cm de large et 5 mm de profondeur ;
– circulaire : punch de différents diamètres (0,5 – 0,6 – 0,8) et 5 mm de profondeur.
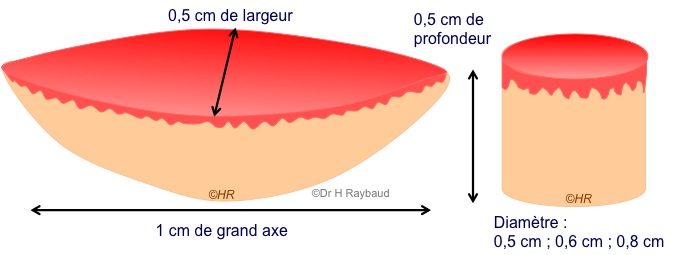
Figure 3. Dimensions idéales d’une biopsie.
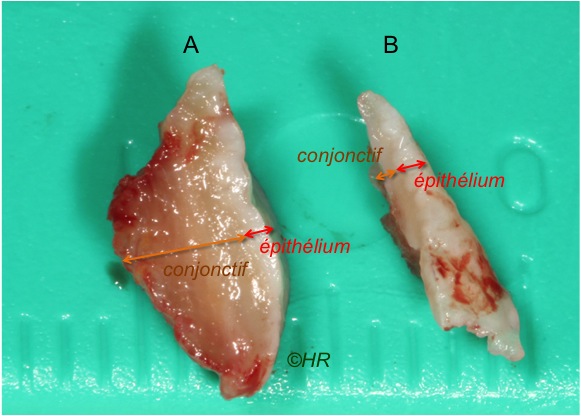
Figure 4. Biopsie de muqueuse linguale : A- profondeur de prélèvement suffisante (5 mm) ; B- profondeur insuffisante (1-2 mm), ne concerne pratiquement que l’épithélium.
Orientation du prélèvement :
Pour les muqueuses, le prélèvement doit être orienté de manière à pouvoir observer la jonction chorio-épithéliale, ce qui peut être particulièrement difficile pour les biopsies de petite taille (figures 5 et 6).
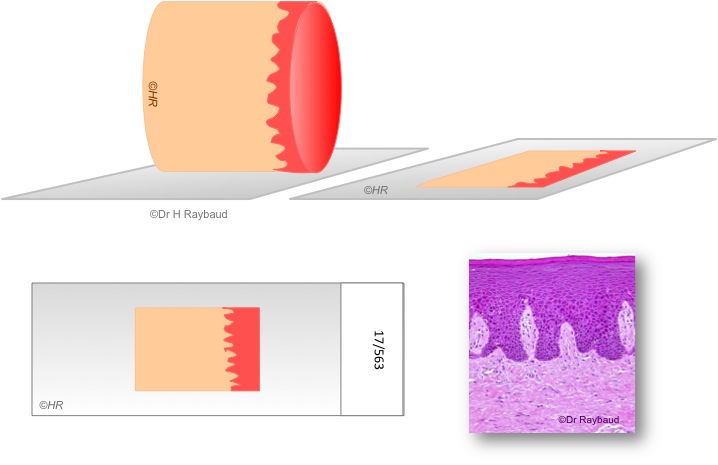
Figure 5. Bonne orientation du prélèvement.
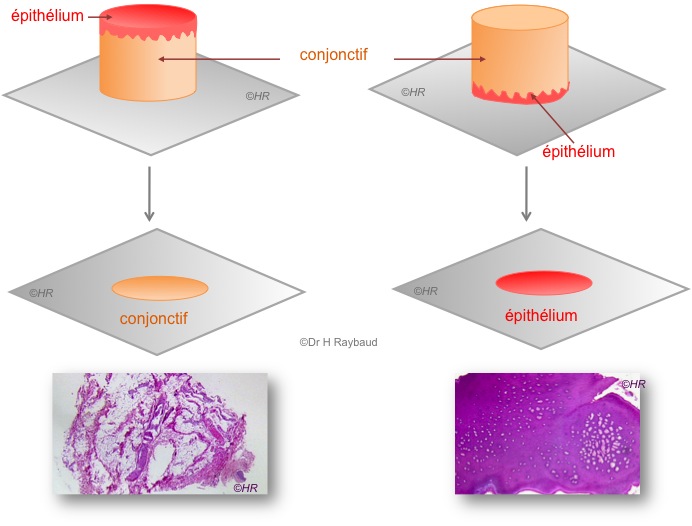
Figure 6. Mauvaises orientation d’un prélèvement.
La fixation :
Elle doit être immédiate sinon il y a un risque d’altération, de nécrose cellulaire, occasionnant une difficulté d’interprétation.
Le fixateur est fourni par le laboratoire d’anatomie pathologie, dans un récipient transparent suffisamment large pour ne pas comprimer le prélèvement (délai de conservation de 3 à 6 mois). Son volume doit représenter 10 à 20 fois le volume de la biopsie.
Le formol 10% est le fixateur le plus utilisé, il permet les immunomarquages et certaines études de biologie moléculaire. Son temps de fixation est d’environ 12 heures pour une biopsie de taille moyenne.
Rappelons que le sérum physiologique n’est pas un fixateur et qu’il produit des altérations irréversibles.
La congélation : prélèvements non fixés
La congélation (figure 7) autorise l’immunofluorescence directe, ainsi que des techniques de biologie moléculaire et de cytogénétique mais elle ne permet pas de réaliser de bonne analyse morphologique ; elle doit être associée à une biopsie fixée au formol.
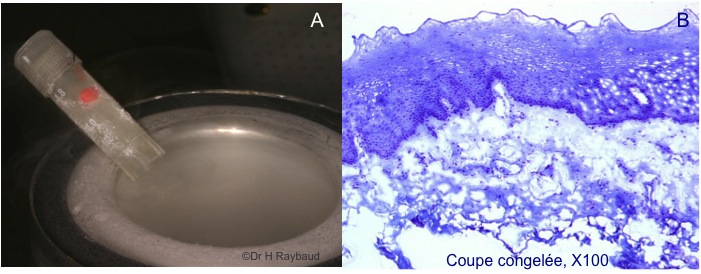
Figure 7. A- le prélèvement est mis dans le tube (spécial congélation) et plongé dans l’azote liquide ; B- mauvaise morphologie tissulaire sur les coupes congelées.
Identification du prélèvement :
Elle est obligatoire avant d’adresser le prélèvement au laboratoire d’anatomo-pathologie. Celui-ci est accompagné d’un formulaire de demande d’examen fournissant les renseignements cliniques, indispensables à une bonne interprétation des coupes.
Si on effectue plusieurs prélèvements, il faut numéroter et identifier chacun d’eux dans un pot différent et le préciser sur la fiche de renseignement sur laquelle un schéma peut être rajouté.
Flacon (pas sur son bouchon) :

Fiche de demande d’examen avec l’identité du laboratoire :
– informations concernant l’identité du patient : nom, prénom, âge, sexe, numéro de dossier, profession si cela a un rapport avec la maladie
– informations concernant l’identité du prescripteur / préleveur : nom, prénom
– destinataire
– date, heure et fixateur utilisé
– examen réalisé : biopsie-exérèse, biopsie-incision, cytologie, énucléation d’un kyste
– nature du prélèvement : muqueux, glandes salivaires, lésion kystique…
– description clinique de la lésion : siège, taille, aspect (consistance, couleur, forme, limites)
– historique de la lésion : symptômes, mode d’apparition, durée, évolution, récidive…
– antécédents du patient : tabac, alcool
– examens radiologiques de la lésion si elle est osseuse
– traitements éventuels locaux et généraux
– diagnostic présumé ou hypothèses de diagnostic qui pourront orienter le pathologiste
– schéma (notamment dans les cas de prélèvements multiples)
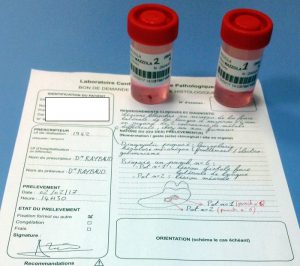
Figure 8. Flacons et feuille de renseignements.
Ce qu’il faut faire :![]()
– Pratiquer des incisions profondes : la biopsie doit intéresser l’épithélium et le conjonctif sous jacent, les lésions siègent souvent en profondeur.
– Saisir le spécimen délicatement avec une pince à mords plats ou un fil, ne faut pas serrer / écraser le prélèvement avec une pince, on réalise la première incision du côté le plus difficile puis on passe le fil de suture pour tirer le prélèvement et réaliser la seconde incision.
– Fixer immédiatement.
– Si le prélèvement est volumineux, le couper en tranche de 5 millimètres pour une meilleure pénétration du fixateur.
– Suturer la plaie pour favoriser la cicatrisation et empêcher les infections secondaires.
– Remplir le formulaire de renseignements.
![]() Ce qu’il ne faut pas faire :
Ce qu’il ne faut pas faire :
– Utiliser un anesthésique de contact ou nettoyer la surface de la lésion peut entraîner une altération de la surface du prélèvement.
– Utiliser un bistouri électrique ou un laser : entraîne un phénomène de brûlure à la périphérie du prélèvement / polarisation du noyau des cellules qui peuvent entraîner des erreurs de diagnostic.
– Anesthésier dans la lésion : ne pas injecter dans la lésion mais autour et/ou dessous à 1 cm environ des limites du prélèvement, en petite quantité, très doucement car la pression peut dilacérer les tissus et dissocier la lésion.
– Rincer le prélèvement avant de mettre dans le fixateur : peut faire éclater les cellules par pression osmotique.
– Rentrer de force un prélèvement dans un flacon trop étroit.
– Laisser sécher le prélèvement avant de le fixer.
– Tirailler, traumatiser, écraser le prélèvement avec 1 pince / précelles.
– De petite biopsie : un fragment minuscule sera difficilement orientable et interprétable.
